دستگاههای پتانسیواستات/گالوانواستات در برخی مدلها مجهز به ماژول اندازهگیری امپدانس الکتروشیمیایی (EIS) هستند. این تجهیزات با سختافزار و نرمافزار پیشرفته خود قادرند جریان، ولتاژ و امپدانس نمونههای مختلف را با دقت بالا و قدرت تفکیک عالی اندازهگیری کنند و به همین دلیل ابزارهایی توانمند برای انواع مطالعات الکتروشیمیایی، حسگرها، بررسی خوردگی و پژوهش در سلولهای خورشیدی محسوب میشوند.
در حالت پتانسیواستات، تکنیکهای استاندارد الکتروشیمیایی شامل:
- ولتامتری روبشی خطی (LSV)
- ولتامتری چرخهای (CV)
- کرونوآمپرومتری
- تکنیکهای پالس ولتامتری مانند پالس نرمال، پالس تفاضلی و موج مربع
ارائه میشوند.
تکنیک EIS یکی از قدرتمندترین روشها برای بررسی خوردگی فلزات، جذب و واجذب سطحی، سینتیک واکنشهای کاتالیستی و مطالعه فصل مشترک لایهها در سلولهای خورشیدی و پیلهای سوختی است. دادههای امپدانس بهدستآمده برای رسم نمودارهای Nyquist و Bode مورد استفاده قرار میگیرند و تحلیلهای دقیقتری از فرآیندهای انتقال بار و رفتار الکتروشیمیایی ارائه میدهند.
همچنین در مطالعات نیمهرساناها، آنالیز Mott–Schottky اطلاعات مهمی از جمله Flat-band potential و Free carrier density را استخراج میکند و امکان بررسی ویژگیهای الکترونیکی مواد را فراهم میسازد.
بسته به نوع کاربرد، اتصالات دستگاه به سلول الکتروشیمی میتواند (یا باید) به صورت متفاوتی انجام شود. در ادامه، سه چیدمان رایج استفاده شده برای سلول الکتروشیمی همراه با نقش الکترودهای استفاده شده در اندازهگیری الکتروشیمی اشاره میشود.
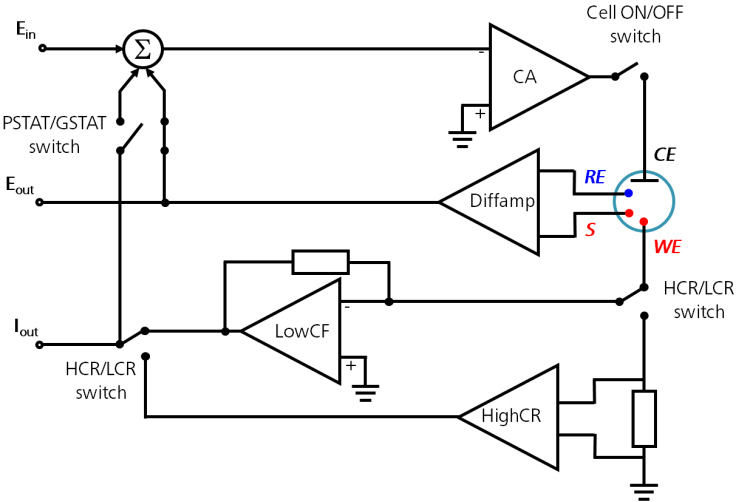
دیاگرام پایه یک پتانسیواستات / گالوانواستات در شکل زیر آورده شده است.
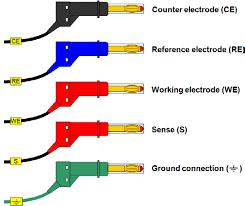
الکترودهای استفاده شده در الکتروشیمی
در یک سلول الکتروشیمیایی سه الکترود اصلی وجود دارد که هرکدام نقش متفاوتی در کنترل و اندازهگیری فرآیند الکتروشیمیایی ایفا میکنند: الکترود کار (WE)، الکترود مرجع (RE) و الکترود مقابل یا کمکی (CE).
الکترود مقابل (Counter Electrode – CE)
الکترود مقابل که «الکترود کمکی» نیز نامیده میشود، وظیفه بستن مسیر جریان در سلول الکتروشیمی را برعهده دارد. این الکترود معمولاً از مواد بیاثر و پایدار مانند پلاتین، طلا، گرافیت یا کربن شیشهای ساخته میشود و در واکنش الکتروشیمیایی شرکت نمیکند.
از آنجایی که جریان بین WE و CE برقرار میشود، سطح مؤثر CE باید بزرگتر از سطح الکترود کار باشد تا خود بهعنوان یک عامل محدودکننده در سینتیک واکنش عمل نکند و جریان بهصورت پایدار برقرار بماند.
الکترود مرجع (Reference Electrode – RE)
الکترود مرجع، الکترودی با پتانسیل پایدار و دقیق است که بهعنوان نقطه صفر یا مبنای اندازهگیری پتانسیل در سلول الکتروشیمی استفاده میشود.
این پایداری معمولاً از طریق یک سیستم اکسایش–کاهش با غلظت ثابت یا اشباعشده ایجاد میشود (مانند Ag/AgCl یا SCE). برای جلوگیری از تغییر پتانسیل، جریان باید نزدیک به صفر باشد. این موضوع توسط امپدانس ورودی بسیار بالا در پتانسیواستات (بیش از 100 GΩ) و انتقال جریان تنها بین WE و CE تضمین میشود.
الکترود کار (Working Electrode – WE)
الکترود کار سطحی است که واکنش اصلی الکتروشیمیایی روی آن رخ میدهد. جنس WE بسته به نوع آزمایش انتخاب شده و معمولاً از مواد بیاثر مانند طلا، نقره، پلاتین، کربن شیشهای (GC) یا الکترود قطره جیوه ساخته میشود.
در مطالعات خوردگی، الکترود کار معمولاً همان نمونه فلزی تحت بررسی است. ابعاد، شکل و جنس الکترود کار میتواند متناسب با نوع تحقیق یا کاربرد تغییر کند.
چیدمان دو الکترودی
در چیدمان سلول دو الکترودی (شکل 4)، CE و RE به یکی از الکترودها متصل میشوند، درحالی که WE و S به الکترود مقابل متصل میشوند. پتانسیل در سلول کامل اندازهگیری میشود. این شامل مشارکت واسط CE/الکترولیت و خود الکترولیت است. این پیکربندی زمانی که کنترل دقیق پتانسیل بین صفحهای در واسط الکتروشیمی WE ضروری نباشد و رفتار کل سلول تحت بررسی مطلوب باشد استفاده میشود. این چیدمان معمولاً با ذخیرهساز انرژی یا وسیله مبدل همانند باتری، پیل سوختی، پانلهای فتوولتائیک و غیره استفاده میشود. آن همچنین برای اندازهگیری دینامیکهای بسیار سریع فرایندهای الکترود یا اندازهگیری امپدانس الکتروشیمی در فرکانسهای بالا (بیشتر از 100 کیلوهرتز) استفاده میشود.
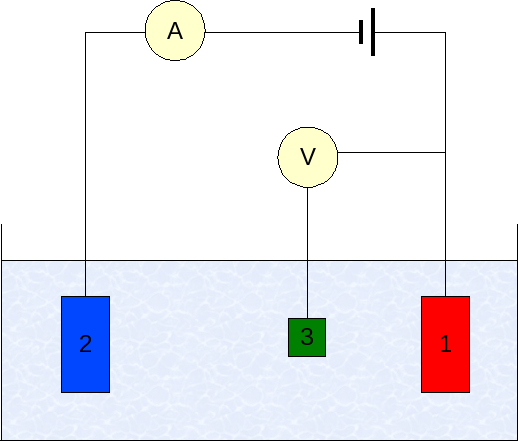
چیدمان سه الکترودی
چیدمان سلول سه الکترودی رایجترین چیدمان سلول الکتروشیمیایی استفاده شده در الکتروشیمی است (شکل 5). در این حالت، جریان بین CE و WE جاری میشود. اختلاف پتانسیل بین WE و CE کنترل میشود و بین RE (که در نزدیکی WE نگه داشته میشود) و S اندازهگیری میشود. چون WE به S متصل است و WE در شبه زمین نگه داشته شده است (پتانسیل ثابت شده و پایدار)، با کنترل پلاریزاسیون CE، اختلاف پتانسیل بین RE و WE در کل زمان کنترل میشود. پتانسیل بین WE و CE معمولاً اندازهگیری نمیشود. این ولتاژ اعمالی توسط تقویت کننده کنترلی است و توسط ولتاژ انطباق دستگاه محدود شده است. آن تنظیم شده است تا این که اختلاف پتانسیل بین WE و RE برابر با اختلاف پتانسیل تعیین شده توسط کاربر شود. این پیکربندی باعث کنترل پتانسیل واسط الکتروشیمی در WE نسبت به RE شود.
شماتیک چیدمان سه الکترودی
برای کاهش تلفات اهمی به دلیل وجود محلول باقی مانده بین RE و WE (مقاومت جبران نشده نامیده میشود)، خاصیت مویینگی لوگین-هابر (یا فقط لوگین) میتواند برای نزدیک کردن ته RE تا جای ممکن به سطح WE (شکل 5) استفاده شود. چون تقریباً، هیچ جریانی در الکترود مرجع جاری نمیشود (معمولاً جریان نشتی حداکثر در حدود چند پیکو آمپر است)، هیچ افت ولتاژی یا افت ولتاژ کم در لوله مویرگی وجود دارد که تضمین میکند ته لوله مویین در پتانسیل نزدیک به پتانسیل RE است.
چیدمان چهار الکترودی
چیدمان سلول چهار الکترودی (شکل 6) برای کاربردهایی استفاده میشود که نیاز به اندازهگیری اختلاف پتانسیل (بین RE و S) موجود در نتیجه مسیر جریان در واسط مشخص (بین WE و CE) دارد. این نوع چیدمان آزمایشگاهی در الکتروشیمی رایج نیست و معمولاً برای اندازهگیری پتانسیل پیوند بین دو فاز غیرقابل اختلاط یا در غشا با توجه به امکان محاسبه مقاومت واسط یا هدایت غشا استفاده میشود.









Reviews
There are no reviews yet.